北理工在“簇发光”螺环聚合物用于肿瘤细胞识别与诊断取得研究成果
发布日期:2020-02-25 供稿:材料学院 蔡政旭
编辑:邵泽 审核:金海波 阅读次数:P53是一种肿瘤抑制蛋白,它可以控制受到损伤的DNA进行修复或使受损伤较大的细胞进入凋亡过程,避免其在不利条件下无限分裂。在肿瘤细胞中,p53的表达和活性往往受到高表达的MDM2蛋白抑制,其机理是p53可以插入MDM2蛋白的Trp26,Phe19和Leu26疏水腔中,并与其紧密结合,从而生理活性受到限制。
近日,在国家自然科学基金重大项目(批准号:21490574)和面上项目(批准号:21474009和51673024)资助下,星空手机网页版登录入口,星空(中国)董宇平课题组与韩国高丽大学Kim Jong Seung课题组合作,报道了利用肿瘤细胞中高表达的MDM2蛋白与非传统共轭的螺环聚合物结合,在产生“簇”发光的同时,限制p53与MDM2蛋白结合,从而释放并活化p53蛋白,促进了癌细胞凋亡,实现对肿瘤细胞靶向诊断和治疗的相关工作。
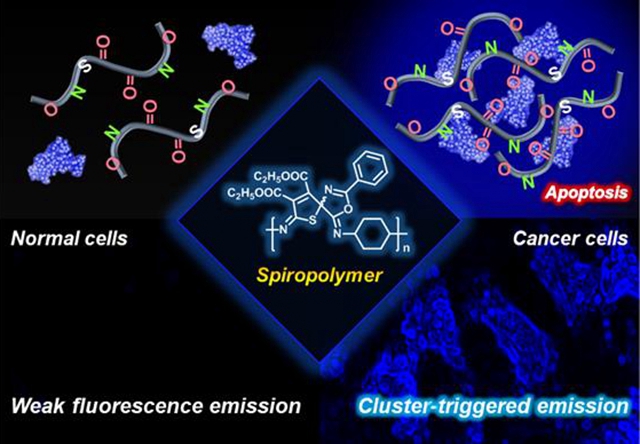
螺环化合物因其独特的化学结构,具有良好的生物活性和稳定性,目前已被用于多种药物中,如依尼螺酮、丁螺环酮等,但螺环聚合物的合成与应用却少见报道。本成果首先利用“无催化、一步法”三键聚合反应合成了新型螺环聚合物。实验结果表明该螺环聚合物具有典型的簇发光(Cluster Triggered Emission, CTE)特性。体外条件下,MDM2蛋白可以与螺环聚合物发生相互作用,诱导P1a2b进一步聚集而引发簇发光;因此在MDM2高表达的多种肿瘤细胞中均呈现明显的蓝色荧光,然而在MDM2蛋白低表达的正常细胞则无明显发光,能够实现对正常细胞和肿瘤细胞的有效区分,并且高分子量P1a2b成像效果更为明显。作者通过MDM2的抑制剂Nutlin-3与P1a2b的竞争实验验证细胞内P1a2b螺环聚合物的作用位点,发现P1a2b与Nutlin-3混合后的MDM2蛋白和细胞相互作用,均不能表现簇发光特性,表明Nutlin-3优先占据了MDM2蛋白的作用位点,使P1a2b不能与之有效结合,进而不能引发聚合物簇聚集发光。
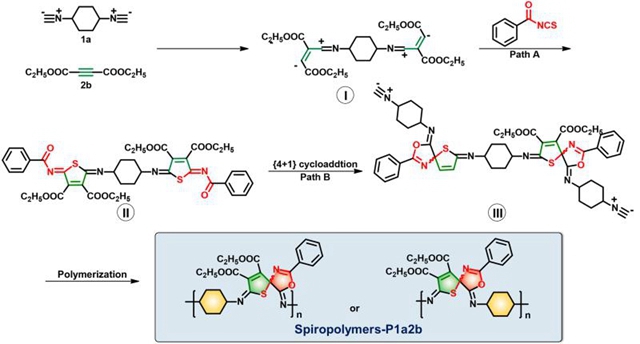
图1 螺环聚合物的合成路线
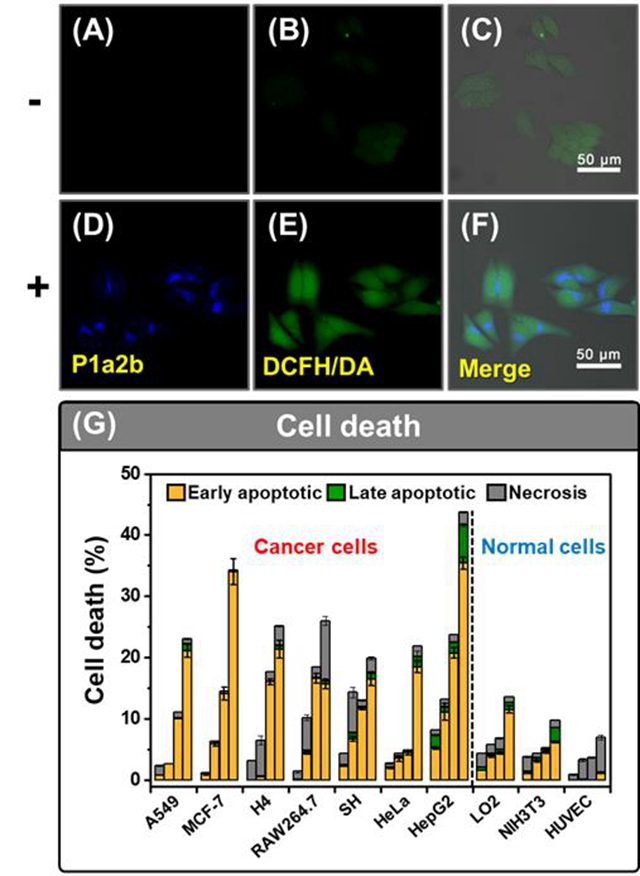
图2 (A)(B)(C) 未加P1a2b聚合物的DAPI,FITC场与合并照片;(D)(E)(F) 加入P1a2b聚合物的DAPI,FITC场与合并照片;(G) 与P1a2b聚合物共培养24 h, 48 h, 72 h后的细胞凋亡率。
随后,作者利用蛋白质免疫印迹法(Western blot)证实了经过P1a2b共培养细胞中的p53蛋白的表达增加。同时证明了P1a2b加入后,p53的增加会导致其相关的ROS浓度的增长,解释了P1a2b聚合物诱使肿瘤细胞高凋亡的主要原因。同时,作者利用分子对接软件,将P1a2b的三聚体与MDM2蛋白计算,证实其与Trp26,Phe19和Leu26疏水空腔结合,且结合稳定。
鉴于该螺环聚合物合成简单,具备肿瘤细胞靶向诊断与治疗相结合的能力,为新型螺环聚合物应用提供了新思路,为肿瘤的治疗和诊断提供了新方法。刘派和付伟强博士为此工作共同第一作者,蔡政旭特聘研究员、董宇平教授、Kim Jong Seung教授为此工作通讯作者。
这一成果近期发表在Angewandte Chemie International Edition上,原文链接为: https://onlinelibrary.wiley.com/doi/10.1002/anie.201916524。
分享到:
